前幾篇先補充價電子為「作為產生化學反應(形成化學鍵)代價的電子」的基礎觀念,再有形式電荷為「該原子實際情況的價電子數與它在元素週期表被公認的價電子數之差額」的第二階觀念,接著導入第三階「正離子與負離子」的觀念。如同蓋房子一般,從基礎開始層層往上疊加。這些觀念屬於價鍵理論(Valance Bond Theory,VB Theory)的範圍,其結構式也採用路易斯結構(Lewis Structures)的書寫方式。然而,採用路易斯結構表示分子的結構會衍生一個問題:「描述同樣一個分子,卻有結構骨架相同但形式電子分布卻不同的多種結構式。」於是《有機化學天堂秘笈》上冊第2章開始介紹「共振(resonance)」這個路易斯結構表示法的折衷之道。
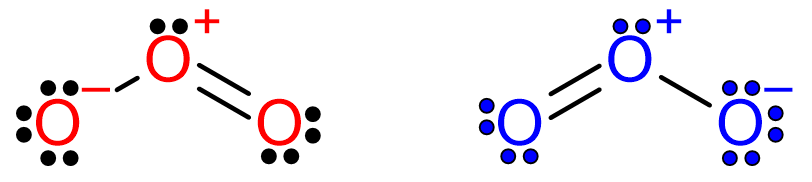
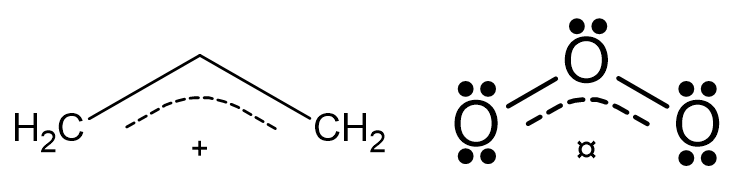
先從字面來看,共振的英文resonance,其字首re為「重覆」而字根son為「發聲/說」。那麼共振要重覆說什麼呢?就是重覆說一個分子的結構式。那為什麼要重覆說呢?如前所述,這是因為用路易斯結構來表達分子結構,會有結構骨架相同,電子分布不同的問題,例如臭氧O3的路易斯結構因為電子分布的位置不同,會有兩種不同的結構式如下圖,這兩種都不能「各別單獨」正確表達臭氧的路易斯結構:
針對上述問題,《有機化學天堂秘笈》上冊第2章的折衷之道,先說了二大戒律「絕對不能打斷單鍵(單一共價鍵)、絕不能違反八隅體法則」,再告訴讀者畫出所有的共振結構有「未(與其他原子)共用的電子對轉為π鍵(π發音為『派pi』,指雙鍵及叄鍵)、π鍵轉為未共同電子對、π鍵轉為另一根π鍵」的方式,甚至又提醒有「緊鄰π鍵的未共用電子對、緊臨正(形式)電荷的未共用電子對、緊臨正(形式)電荷的π鍵、π鍵其中一端原子為負離子(詳另篇巴文)、繞整個環的π鍵」就有可能又多出一種共振結構,最後在2.8節表示「其實你畫那麼多共振結構,只有他X的幾個比較重要,就是(形式)電荷越少越好、負的(形式)電荷連在負離子上的結構越重要、啊原子環繞的電子數不能違反八隅體法則」惹毛讀者。
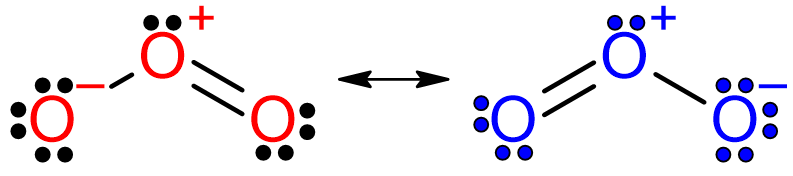
經過上述作者把路易斯結構式的折衷變成「折騰/折磨」等過程,他對於臭氧O3的結構表示結果,竟然就只是用一個雙頭箭號放在這些「理論上最重要而其他不重要」的二個共振結構之中,讓它們代表臭氧分子的路易斯結構式,統稱這是「共振結構」(resonance structures)如下圖:
經過上述作者把路易斯結構式的折衷變成「折騰/折磨」等過程,他對於臭氧O3的結構表示結果,竟然就只是用一個雙頭箭號放在這些「理論上最重要而其他不重要」的二個共振結構之中,讓它們代表臭氧分子的路易斯結構式,統稱這是「共振結構」(resonance structures)如下圖:
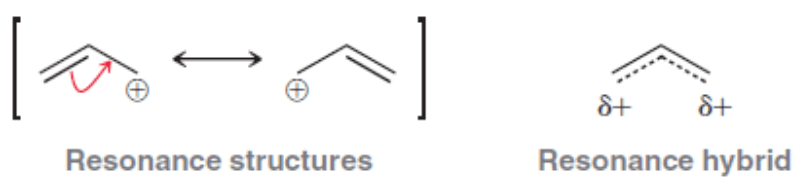
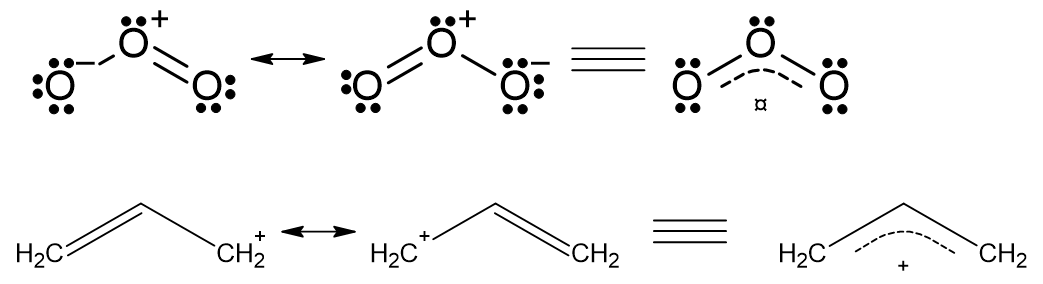
上圖因為是臭氧分子,而且也沒畫一堆彎曲箭號讓讀者誤會電子會跑來跑去,甚至也沒有一個大括號包住全部的結構,所以已經算很簡捷不複雜。但是這樣的書寫方式實用嗎?《有機化學天堂秘笈》的作者 David Kleim 沒再說下去了。反而他另一本書《有機化學》第三版(Organic Chemistry 3rd edition)第79頁介紹一個更簡捷的表示法「共振混合體(resonance hybrid)」如下:
作者寫這麼一堆,上圖只是傳達一件事:「因為共振結構太麻煩而且生出太不穩定的累贅結構,所以我們最後還是用共振混合體(resonance hybrid)來表示一個分子,而且這個表示方式很穩定不會造成誤會。」
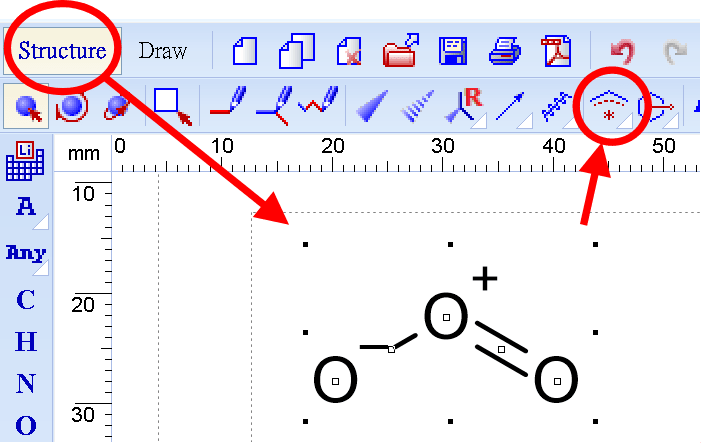
對於《有機化學天堂秘笈》事倍功半、冗長甚至疏漏共振混合物的第2章內容,免費的有機化學繪圖軟體ChemSketch如何處理?很簡單,就只是在Structure狀態下把整個分子圈選起來,點個「Dotted Delocalization Curve」就自動生成一個共振混合體(resonance hybrid)如下圖。
雖然表示方式略有不同,仍可CHemSketch看出「離域化(delocalization,指正或負電荷不會只在單一原子,而是在兩邊原子的電子域轉檯,說這樣原子之間的連結較穩定)」的是正電荷還是負電荷。左圖是正形式電荷的hybrid,右圖是負形式電荷的hybrid。
雖然作者在《有機化學天堂秘笈》上冊第39頁強調「共振可說是有機化學從頭到尾,無所不在的一個議題。」但是我翻了整本上冊,也只有第3章酸鹼反應的羧酸有提到它,而且影響力還是第二不是第一。共振結構不是真正的分子結構,只是路易斯結構的表達方式不明確的折衷之道。共振結構之間的骨架是相同的,只有鍵結與形式電荷不同。然而對於我這個初學者而言,卻容易與同分異構物(同分子式,不同結構式)混淆在一起。
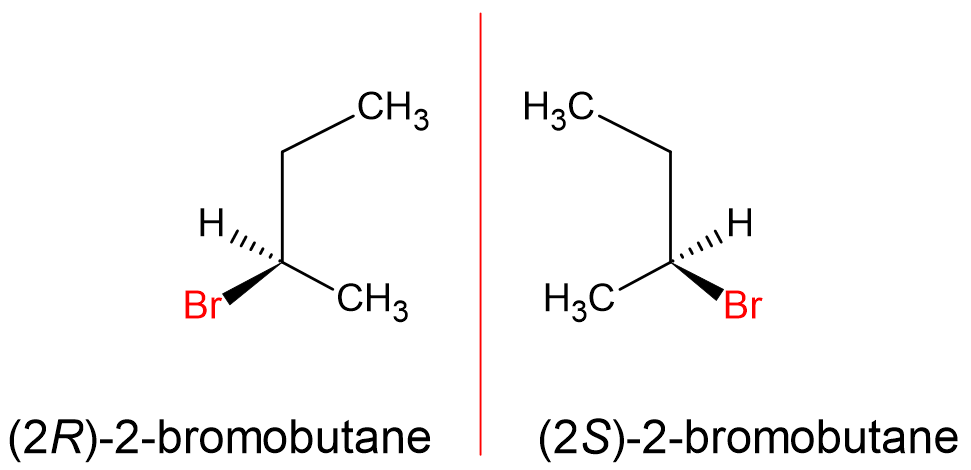
因此在本文的最後,我先列出2溴丁烷的二個同分異構物「鏡像異構物」如下圖(分子式都是「C4H9Br」,但是結構式卻不一樣),如同左手與右手對稱(又稱手性),有如鏡像一般。
然後再列出下圖共振結構及共振混合物作比較,避免各位讀《有機化學天堂秘笈》上冊第2章一時不察落入作者冗長又不齊全的篇幅地獄,混淆了共振結構與同分異構體。