本文補充《有機化學天堂秘笈》沒特別強調的正離子與負離子概念(在上冊第77頁僅以『具陰電性的原子上』帶過)。本篇分三部分,先複習一下「電子組態(Electron Configuration)」的概念,再以鋰元素(Li,Lithium)及氟元素(F,Fluorine)為例,用免費化學繪圖軟體 ChemSketch 內建的元素週期表(Periodic Table of Elements)簡單說明。
(二)原子核由「帶正電的質子」與「中性的中子」組成。
(三)電子雲由「帶負電的電子」組成,分為最內層的K(只能住2個電子)到第二層的L(8個電子)、第三層M層(18個電子)、第四層的N層(32個電子)。更高層在有機化學不常用,就不說了。
(四)電子會先住K層,住滿再換L層,依此類推。有電子住的最外層叫作「價殼層」,這裡的電子被稱作「價電子」,作為「產生化學反應(形成化學鍵)的代價」,詳見另一篇巴文(連結傳送門)。
(五)原子呈中性是指「未帶正電或負電」,即「帶正電的質子」與「帶負電的電子」雙方數量旗鼓相當。不過有些元素因為電子組態的關係,會傾向「丟掉電子讓整個原子帶正電」形成正離子,例如鋰原子,這時就說鋰元素的負電性(electronegativity) 較低。另一些則傾向「搶電子讓整個原子帶負電」形成負離子,例如氟原子,這時就說氟元性的負電性(electronegativity) 較高。這二個例子介紹如下。
(一)開啟ChemSketch,點選左上角元素週期表(Periodic Table of Elements)按鈕,如紅圈標示。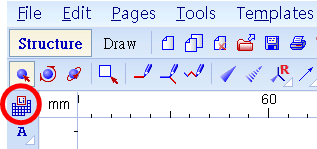
(二)在元素週期表點選鋰元素(Li)後,可知鋰元素全名為 Lithium 而原子序為 3,表示其原子核有帶正電的質子數3個,相對的外層電子雲帶負電的電子數也有3個,讓整個原子呈中性;也因此其電子組態(Electron configuration)為K層住滿2個電子,L層有8個空位卻只住了一個電子,表示為 2-1。
(三)因為鋰原子電子雲的最外層L層,即價殼層,有8個空位卻只住了一個電子,所以化學反應(與其他原子作交易時),鋰原子有兩種交易選擇:「放生L層這唯一的房客」或「拉7個新房客住進來」。前者交易產生形式電荷+1(因為帶負電的電子剩2個,但原子核帶正電的質子不動如山有3個,整體結算就是+1),後者交易會有形式電荷-7(負電的電子增到10個,原子核帶正電的質子只有3個,結算就是-7)。就化學穩定性而言,形式電荷越低(形式電荷詳見另一篇巴文連結),就越穩定。所以鋰原子會選擇第一種交易方式,產生形式電荷+1。這點可從前面的元素週期表下方資訊看出來,鋰元素的負電性(Electronegativity)只有0.98,遠低於碳元素的2.55。鋰元素相較碳元素,為交易(發生化學反應)時傾向成為帶1個正電的正離子(cation)。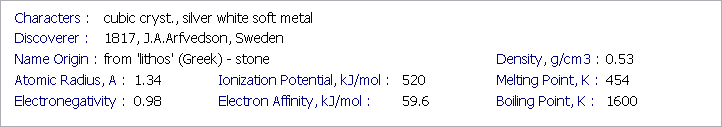
(一)氟元素的例子,可比照前面鋰元素的ChemSketch元素週期表查詢方式,查到它相較於碳元素,在交易(發生化學反應)時傾向變為帶1個負電的負離子(anion)。它的價殼層有7個電子,負電性高達3.98高於碳元素的2.55。
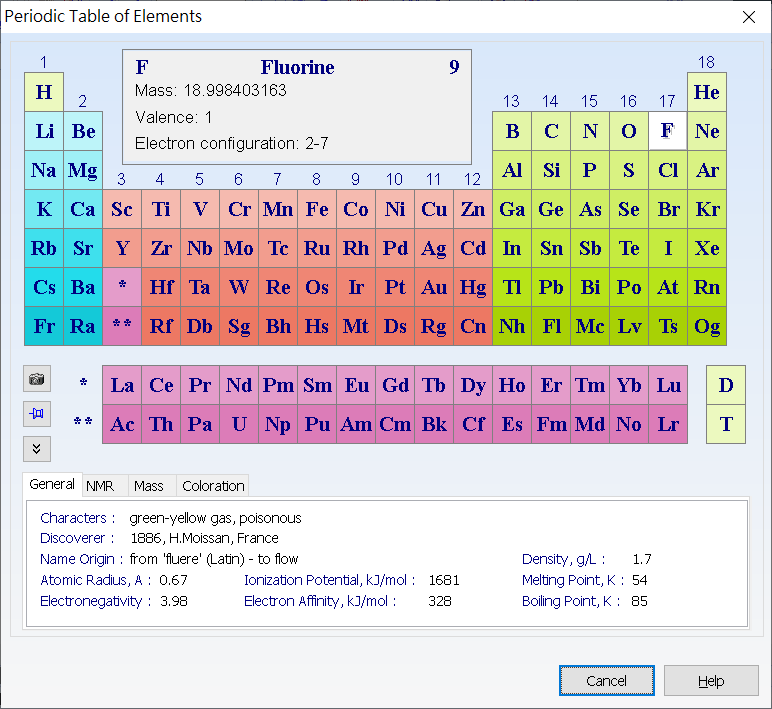
(二)這裡特別要說明的是,如果在元素週期表點選氟元素後再點選繪畫區,會畫出「HF」而非「F-」,不像鋰原子直接畫出「Li+」。如果想要拿掉氫原子H,千萬不要用工具列「Tools / Add Explicit Hydrogens」再想刪掉H原子,因為H原子「長出來在結構式獨立出現就不能刪除」。
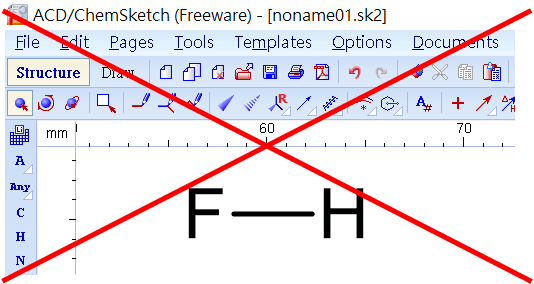
(三)要正確刪除氫原子,請先設定「「Tools / Remove Explicit Hydrogens」讓結構式恢復為「HF」,再點擊左下角的「Increment(+) Charge」鈕的右下白色三角形,切換為「Decrement(-) Charge」再點擊HF,就成為我們想要的F-結構。步驟如下圖:
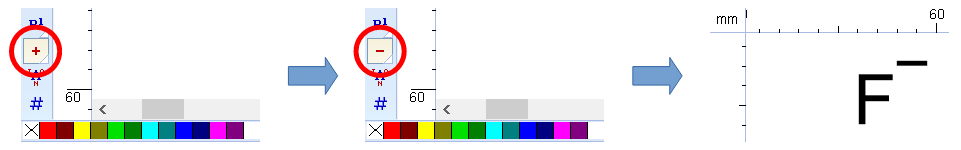
一、電子組態的基本觀念5項
(一)整個原子由「原子核」與「電子雲」組成。
(一)整個原子由「原子核」與「電子雲」組成。
(二)原子核由「帶正電的質子」與「中性的中子」組成。
(三)電子雲由「帶負電的電子」組成,分為最內層的K(只能住2個電子)到第二層的L(8個電子)、第三層M層(18個電子)、第四層的N層(32個電子)。更高層在有機化學不常用,就不說了。
(四)電子會先住K層,住滿再換L層,依此類推。有電子住的最外層叫作「價殼層」,這裡的電子被稱作「價電子」,作為「產生化學反應(形成化學鍵)的代價」,詳見另一篇巴文(連結傳送門)。
(五)原子呈中性是指「未帶正電或負電」,即「帶正電的質子」與「帶負電的電子」雙方數量旗鼓相當。不過有些元素因為電子組態的關係,會傾向「丟掉電子讓整個原子帶正電」形成正離子,例如鋰原子,這時就說鋰元素的負電性(electronegativity) 較低。另一些則傾向「搶電子讓整個原子帶負電」形成負離子,例如氟原子,這時就說氟元性的負電性(electronegativity) 較高。這二個例子介紹如下。
二、鋰原子易形成正離子(cation)
(一)開啟ChemSketch,點選左上角元素週期表(Periodic Table of Elements)按鈕,如紅圈標示。
(二)在元素週期表點選鋰元素(Li)後,可知鋰元素全名為 Lithium 而原子序為 3,表示其原子核有帶正電的質子數3個,相對的外層電子雲帶負電的電子數也有3個,讓整個原子呈中性;也因此其電子組態(Electron configuration)為K層住滿2個電子,L層有8個空位卻只住了一個電子,表示為 2-1。
(三)因為鋰原子電子雲的最外層L層,即價殼層,有8個空位卻只住了一個電子,所以化學反應(與其他原子作交易時),鋰原子有兩種交易選擇:「放生L層這唯一的房客」或「拉7個新房客住進來」。前者交易產生形式電荷+1(因為帶負電的電子剩2個,但原子核帶正電的質子不動如山有3個,整體結算就是+1),後者交易會有形式電荷-7(負電的電子增到10個,原子核帶正電的質子只有3個,結算就是-7)。就化學穩定性而言,形式電荷越低(形式電荷詳見另一篇巴文連結),就越穩定。所以鋰原子會選擇第一種交易方式,產生形式電荷+1。這點可從前面的元素週期表下方資訊看出來,鋰元素的負電性(Electronegativity)只有0.98,遠低於碳元素的2.55。鋰元素相較碳元素,為交易(發生化學反應)時傾向成為帶1個正電的正離子(cation)。
三、氟原子易形成負離子(anion)
(一)氟元素的例子,可比照前面鋰元素的ChemSketch元素週期表查詢方式,查到它相較於碳元素,在交易(發生化學反應)時傾向變為帶1個負電的負離子(anion)。它的價殼層有7個電子,負電性高達3.98高於碳元素的2.55。
(二)這裡特別要說明的是,如果在元素週期表點選氟元素後再點選繪畫區,會畫出「HF」而非「F-」,不像鋰原子直接畫出「Li+」。如果想要拿掉氫原子H,千萬不要用工具列「Tools / Add Explicit Hydrogens」再想刪掉H原子,因為H原子「長出來在結構式獨立出現就不能刪除」。
(三)要正確刪除氫原子,請先設定「「Tools / Remove Explicit Hydrogens」讓結構式恢復為「HF」,再點擊左下角的「Increment(+) Charge」鈕的右下白色三角形,切換為「Decrement(-) Charge」再點擊HF,就成為我們想要的F-結構。步驟如下圖:
